(A cura di Luca Pizzino, INGV)
ITA:
ITA
La terra, nella sua porzione più esterna chiamata crosta è formata dalle rocce che, in generale, rappresentano una miscela di solidi costituiti da sostanze chimicamente diverse aggregate strettamente fra loro: ciascuna di queste sostanze è un minerale. Un minerale è una sostanza solida naturale e avente una composizione chimica ben definita espressa da una formula chimica. La crosta terrestre è costituita quasi per il 90% da quattro elementi chimici: ossigeno, silicio, alluminio e ferro. Le acque naturali (superficiali e sotterranee) interagiscono con le rocce e i minerali alterandole/i chimicamente e dissolvendo i costituenti solidi. Gli elementi chimici disciolti nelle acque superficiali provengono prevalentemente dall’alterazione della crosta terrestre la cui composizione, a prescindere da processi antropici, è data dall’insieme dei processi chimico-fisici che vanno sotto il nome di “interazione acqua-roccia”. I processi di alterazione delle rocce da parte delle acque superficiali e sotterranee liberano composti ed elementi, la maggior parte come ioni (positivi, chiamati cationi e negativi chiamati anioni), ma anche in forma molecolare. Essi costituiscono il carico salino di un’acqua naturale e andranno a definire la sua composizione chimica e la facies idrochimica di appartenenza basata sull’abbondanza dei differenti ioni. La composizione di un’acqua sotterranea sarà funzione di numerose variabili quali: i) la natura della roccia e dei minerali con cui interagisce nel suo circuito idrologico, ii) il tempo di residenza nell’acquifero, iii) la differente solubilità dei vari minerali e la velocità di reazione, iv) la temperatura dell’acquifero, v) il contenuto in gas (soprattutto CO2) e vi) l’eventuale miscelamento con acque provenienti da differenti circuiti.
Di seguito verranno illustrati brevemente gli aspetti principali di ognuna di queste variabili.
-
Il carattere acido di una soluzione acquosa è per la massima parte determinato da reazioni in cui è coinvolta la CO2. L'acqua meteorica, prima di giungere al suolo ed iniziare il processo di interazione con le rocce, discioglie, in equilibrio, la CO2 presente in atmosfera (concentrazione pari a 0,037 %). Molto spesso la concentrazione di CO2 nei suoli è notevolmente più elevata (fino a 7% di CO2!) per effetto dell'attività di respirazione delle radici delle piante e la decomposizione di materiale organico (attività biologica). Nelle aree vulcaniche e non vulcaniche caratterizzate da diffuso degassamento, la CO2 può avere origini profonde ed è generata da reazioni che avvengono ad alta temperatura. Più è alto il contenuto in CO2, maggiore sarà la capacità delle acque di aggredire le rocce (incremento del potere corrosivo), causando un più elevato contenuto in sali disciolti.
-
Le rocce contengono minerali di vario tipo, che si disciolgono più o meno facilmente (cioè che hanno, rispettivamente, alta o bassa solubilità): 1) le rocce evaporitiche, prevalentemente gesso e salgemma, sono altamente solubili e liberano solfati, calcio, cloruri, sodio e magnesio quando vengono in contatto con l’acqua (dissoluzione chimica). 2) le rocce carbonatiche (calcari, marmi, dolomie), molto diffuse in natura, si alterano facilmente per azione dell’acqua contenente anidride carbonica e liberano principalmente calcio e bicarbonato (anche il magnesio nel caso della dolomia) e 3) le rocce vulcaniche sono formate da minerali silicatici scarsamente solubili che entrano molto lentamente in soluzione, anche in caso di elevati contenuti in CO2. Con la distruzione della struttura cristallina e il passaggio in soluzione di vari ioni (principalmente Na+, K+, Mg+2, Ca+2), si liberano anche silice e alluminio.
-
La velocità di reazione con cui i differenti minerali reagiscono una volta in contatto con l’acqua, che misura il tempo impiegato dagli elementi chimici per entrare in soluzione, dipende dal tipo di minerale e dal grado di acidità dell’ambiente. In linea generale, la velocità di reazione è favorita da un ambiente acido (aggressivo) e diminuisce dalle evaporiti (cloruri e solfati) ai silicati, con i carbonati come termini intermedi. Questo fattore, insieme alla solubilità, spiega il diverso contenuto salino delle acque che interagiscono con le litologie sopra riportate.
-
La temperatura esercita un’influenza notevole sia sulla solubilità dei minerali sia sulla velocità di reazione. In genere (ma vi sono alcune eccezioni), l’aumento di temperatura favorisce la dissoluzione (disaggregazione delle particelle) dei minerali; gli ioni che ne formavano il reticolo ordinato si disperdono nell’acqua. Si passa così dall’ordine (il reticolo del sale) al disordine (gli ioni sparsi nella soluzione). Inoltre, all'aumentare della temperatura le molecole si agitano maggiormente rendendo più frequenti le collisioni e quindi aumentando la velocità delle reazioni. Ad esempio, le acque termali per la loro temperatura e spesso per presenza di anidride carbonica, talvolta in concentrazione rilevante, hanno una maggiore capacità aggressiva sulle rocce con cui vengono in contatto.
-
Il tempo di residenza nell’acquifero favorisce l’interazione tra le acque circolanti e le rocce e l’instaurarsi dei processi sopra descritti.
I processi di alterazione delle rocce da parte delle acque superficiali e sotterranee liberano quindicomposti ed elementi, la maggior parte come ioni (positivi, chiamati cationi e negativi chiamati anioni), ma anche in forma molecolare. Essi costituiscono il carico salino di un’acqua naturale e andranno a definire la sua composizione chimica e la facies idrochimica di appartenenza basata sull’abbondanza dei differenti ioni. Un’acqua naturale, quindi, riflette la composizione chimica delle rocce con cui ha interagito.
*****************
Alla luce di quanto finora esposto, presentiamo tre differenti tipi di acque. Ognuna di esse è caratterizzata da valori diversi di salinità, pH, contenuto in gas e composizione chimica, espressioni di circolazioni differenti in rocce completamente diverse e differenti condizioni ambientali al contorno. Di conseguenza, ogni acqua avrà un sapore diverso e caratteristico.
1) Circolazione in rocce metamorfiche/intrusive (graniti, ghiacciaio del Monte Rosa, Alpi marittime, regione Piemonte), minimamente mineralizzata e povera in CO2 (è l’acqua meno salina d’Europa);
|
Residuo Fisso a 180°C |
14 |
mg/L |
|
pH |
5,70 |
U pH |
|
Calcio |
1.1 |
mg/L |
|
Sodio |
1,08 |
mg/L |
|
Potassio |
0,32 |
mg/L |
|
Cloro |
0,53 |
mg/L |
|
Magnesio |
0,30 |
mg/L |
|
Solfato |
1,55 |
mg/L |
2) Circolazione in rocce carbonatiche (come sgorga dai rubinetti romani alimentati dalle sorgente del Peschiera e delle Capore, provincia di Rieti), oligominerale e con medio contenuto in CO2;
|
Residuo Fisso a180°C |
413 |
mg/L |
|
pH |
7,60 |
U pH |
|
Calcio |
105 |
mg/L |
|
Sodio |
3,9 |
mg/L |
|
Potassio |
1,02 |
mg/L |
|
Cloro |
6,5 |
mg/L |
|
Magnesio |
18,80 |
mg/L |
|
Solfato |
16,90 |
mg/L |
3) Circolazione in rocce vulcaniche, con alto contenuto in CO2 (acqua minerale dell’area romana).
|
Residuo 180°C fisso a |
638 |
mg/L |
|
pH |
5,95 |
U pH |
|
Calcio |
93,50 |
mg/L |
|
Sodio |
44,50 |
mg/L |
|
Potassio |
56,90 |
mg/L |
|
Cloro |
33,60 |
mg/L |
|
Magnesio |
23,60 |
mg/L |
|
Solfato |
27,30 |
mg/L |
Glossario:
Residuo fisso: Il residuo fisso a 180°C nelle acque minerali si riferisce alla quantità totale di minerali presenti nell'acqua dopo che essa è stata fatta evaporare a 180 gradi Celsius fino a raggiungere un peso costante. Questo valore è espresso in milligrammi per litro (mg/L) ed è indicativo del grado di mineralizzazione dell'acqua. In base a questo valore le acque sono classificate come segue:
-
ACQUE MINIMAMENTE MINERALIZZATE: residuo fisso inferiore a 50 mg/l
-
ACQUE OLIGOMINERALI: residuo fisso inferiore a 500 mg/l
-
ACQUE MINERALI: residuo fisso compreso tra i 500 e i 1000 mg/l
-
ACQUE RICCHE DI SALI MINERALI: residuo fisso superiore a 1500 mg/l
pH: definisce il carattere acido o basico di un’acqua. Alla temperatura di riferimento di 25°C, abbiamo:
-
una soluzione a pH = 7 è neutra.
-
una soluzione a pH < 7 è acida.
-
una soluzione a pH > 7 è basica.
CO2: anidride carbonica, un gas presente in atmosfera e nelle acque naturali.
mg/L: unità di misura utilizzata per indicare la quantità di un elemento chimico presente all’interno di un litro di acqua naturale.
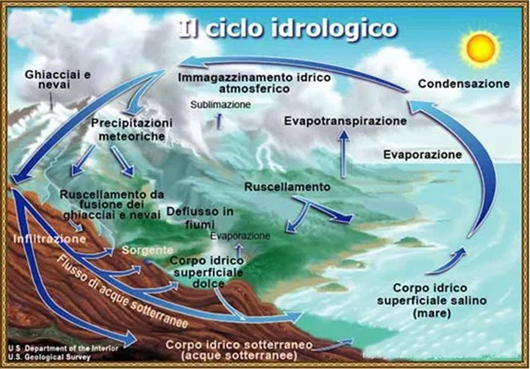
Il ciclo dell'acqua si svolge in quattro fasi:
-
Evaporazione
-
Condensazione
-
Precipitazione
-
Ruscellamento/Infiltrazione.
-
L'evaporazione è il trasferimento dell'acqua da corpi idrici superficiali all'atmosfera. Questo trasferimento implica un passaggio di stato dalla fase liquida alla fase vapore. Nell'evaporazione viene inclusa anche la traspirazione delle piante; in tal modo ci si riferisce a questo trasferimento come evapotraspirazione. Circa l'85% di tutta l'acqua che evapora annualmente nell'atmosfera proviene dai mari (~ 500.000 km3). Il restante 15% deriva dall'evaporazione delle acque superficiali continentali e, per la maggior parte, dalla traspirazione delle piante (evapotraspirazione).
-
La condensazione è un processo fisico che consiste nel passaggio dallo stato gassoso a quello liquido. Nel ciclo idrologico è il vapore acqueo a raggiungere una certa altezza dove si trovano dei nuclei di condensazione (microparticelle di varia natura fortemente igroscopiche che formano piccolissime particelle che a loro volta formano le nubi).
-
La precipitazione è costituita da vapore acqueo che si è prima condensato sotto forma di nuvole e che cade sulla superficie terrestre. Più in dettaglio, quando il vapore acqueo all'interno di una nube condensa in tante goccioline d'acqua, queste si incontrano e fondono tra loro. Quando esse diventano grandi e pesanti a tal punto da non poter essere più trattenute all'interno della nube, cadono, dando origine o alla pioggia (precipitazioni liquide) o a neve/grandine/graupeln o neve tonda (precipitazioni solide) se la temperatura dell’aria è più bassa.
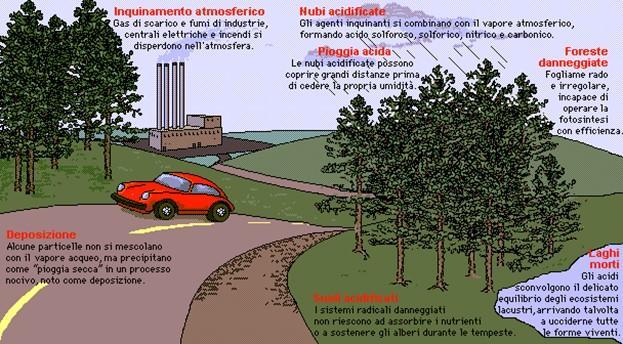
Piogge acide: Una pioggia viene definita acida quando il suo pH è minore di 5. L'aggettivazione acida identifica la pioggia come veicolo per la deposizione degli acidi; più in generale l'appellativo acida può essere apposto a qualsiasi precipitazione che possa fungere da veicolo per la deposizione di acidi al suolo. Nel caso della neve si parlerà di neve acida, per la nebbia di nebbia acida. Tale fenomeno è causato essenzialmente dall'aumento nell'atmosfera di componenti gassosi quali l'anidride solforosa (SO2) e solforica (SO3) provenienti dalle attività industriali (produzione di elettricità, le fabbriche e veicoli a motore, le centrali a carbone), dal traffico veicolare e dalle combustioni in genere. In realtà, i principali fenomeni naturali che contribuiscono all'immissione di gas dello zolfo nell'atmosfera sono le emissioni dei vulcani; nei casi di massiva attività vulcanica si sono osservate precipitazioni con acidità anche a pH 2. Altri inquinanti sono il monossido e il biossido di azoto (NO, NO2). I composti dell’azoto sono principalmente legati agli scarichi dei veicoli (in particolare con motori diesel) che sono il prodotto della combustione del carburante usato, ma sono anche prodotti dall'attività elettrica nell'atmosfera, come per esempio le scariche dei fulmini.
I gas a base di zolfo e azoto gas possono essere trasformati in pochi giorni in acidi tramite la combinazione con l'acqua (H2O). Quando si disciolgono gas acidi quali SOx (molto solubile) e/o NOx il pH delle acque piovane può scendere a 4.0-4.5 formando le piogge acide.
SOx + H2O = H2SOx (se x = 4 acido solforico; se x = 3 acido solforoso)
NOx + H2O = HNOx (se x = 3 acido nitrico; se x = 2 acido nitroso)
Effetti delle piogge acide sull’ambiente naturale e sull’assetto urbano:
-
Acidificazione delle acque superficiali
Le precipitazioni a elevata acidità possono comportare una variazione del pH delle acque superficiali rendendo così l'ambiente inospitale e inadatto alla vita degli animali che generalmente lo occupano. Questo fenomeno comporta una riduzione della fauna e della biodiversità di queste zone. Inoltre l'acidità elevata viene trasmessa tramite la catena alimentare andando quindi a impattare sull'intero ecosistema.
-
Acidificazione del suolo
La pioggia acida che ricade al suolo e viene assorbita riduce il pH del terreno rendendolo un ambiente inadatto alla proliferazione di importanti batteri necessari alla sopravvivenza della vegetazione. L'impoverimento nutritivo del suolo comporta la morte della vegetazione che lo occupa danneggiando anche le coltivazioni e riducendo l'efficienza dei raccolti: i danni delle piogge acide sui raccolti devono quindi essere contrastati utilizzando fertilizzanti e sostanze capaci di ripristinare i nutrienti del suolo.
-
Impatto sulla vegetazione
Anche l'alta vegetazione subisce danni dalle piogge acide riducendone la resistenza e la capacità di sopravvivenza in situazioni più estreme (come le gelate).
-
Impatto sulle città e sulle zone urbane
Nelle città e nelle zone urbane in generale, le precipitazioni acide sono in grado di corrodere e danneggiare edifici e monumenti, in particolare quelli costruiti con pietre calcaree e marmi poiché l'acidità delle piogge reagisce con questi materiali dissolvendoli. Per quanto riguarda l'uomo, la sua salute è compromessa principalmente per gli inquinanti dell'aria e non direttamente dall'acidità delle piogge se non per via delle conseguenze indirette che queste precipitazioni hanno sull'ambiente.
-
In idrologia, il ruscellamento sta ad indicare quel particolare fenomeno dello scorrimento superficiale delle acque che avviene quando le acque meteoriche cadendo a terra incontrano una superficie impermeabile che ne impedisce la filtrazione nel terreno in profondità, fino alla falda sotterranea. Questo processo alimenta ruscelli, torrenti, fiumi e laghi. L’impermeabilizzazione, oltre a ridurre l’infiltrazione delle acque, impedisce l’evapotraspirazione e diminuisce l’umidità del suolo. Quest’ultimo non è più in grado di funzionare da serbatoio e riduce anche la capacità di ricarica delle falde acquifere. Parte dell'acqua piovana s’infiltra in profondità nel terreno ed alimenta gli acquiferi (rocce saturate con acqua mobile che affiora in sorgenti o estraibile con pozzi o gallerie) che immagazzinano enormi quantità di acqua dolce sotterranea per lunghi periodi di tempo. Il ruscellamento è tipico delle grandi città (costruzioni, strade, aree pavimentate, ecc.), delle aree fortemente urbanizzate e delle aree adibite ad agricoltura intensiva a causa della formazione di strati compattati.
-
In idrologia, l’infiltrazione è il fenomeno per cui l’acqua di precipitazione viene assorbita dal terreno, si infiltra e penetra fino a grandi profondità. Scorrendo così nel sottosuolo e tra le rocce, l’acqua alimenta gli acquiferi che immagazzinano enormi quantità di acqua dolce sotterranea per lunghi periodi. Gli acquiferi possono essere sfruttati per scopi idropotabili, agricoli e industriali quando affiorano come sorgenti o tramite pozzi (trivellati o artesiani) e gallerie drenanti.
ENG
ENG (Long Version):
The earth, in its outermost portion called the crust, is made up of rocks which, in general, represent a mixture of solids made up of chemically different substances closely aggregated together: each of these substances is a mineral. A mineral is a natural solid substance having a well-defined chemical composition expressed by a chemical formula. The earth's crust is made up of almost 90% of four chemical elements: oxygen, silicon, aluminum and iron. Natural waters (surface and underground) interact with rocks and minerals, chemically altering them and dissolving the solid constituents. The chemical elements dissolved in surface waters mainly come from the alteration of the earth's crust whose composition, regardless of anthropic processes, is given by the set of chemical-physical processes that go by the name of "water-rock interaction". The processes of alteration of rocks by surface and groundwater release compounds and elements, most of them as ions (positive, called cations and negative called anions), but also in molecular form. They constitute the salt load of natural water and will define its chemical composition and the hydrochemical facies to which it belongs based on the abundance of the different ions. The composition of underground water will be a function of numerous variables such as: i) the nature of the rock and minerals with which it interacts in its hydrological circuit, ii) the residence time in the aquifer, iii) the different solubility of the various minerals and the reaction speed, iv) the aquifer temperature, v) the gas content (especially CO2) and vi) possible mixing with water coming from different circuits.
The main aspects of each of these variables will be briefly illustrated below.
-
The acidic character of an aqueous solution is mostly determined by reactions in which CO2 is involved. The meteoric water, before reaching the ground and starting the process of interaction with the rocks, dissolves, in equilibrium, the CO2 present in the atmosphere (concentration equal to 0.037%). Very often, the concentration of CO2 in soils is significantly higher (up to 7% CO2!) due to the respiration activity of plant roots and the decomposition of organic material (biological activity). In volcanic and non-volcanic areas characterized by widespread degassing, CO2 can have deep origins and is generated by reactions that occur at high temperatures. The higher the CO2 content, the greater the capacity of the water to attack the rocks (increase in corrosive power), causing a higher content of dissolved salts.
-
Rocks contain minerals of various types, which dissolve more or less easily (i.e. which have, respectively, high or low solubility): 1) evaporitic rocks, mainly gypsum and rock salt, are highly soluble and release sulphates, calcium, chlorides , sodium and magnesium when they come into contact with water (chemical dissolution). 2) carbonate rocks (limestone, marble, dolomite), very widespread in nature, are easily altered by the action of water containing carbon dioxide and mainly release calcium and bicarbonate (also magnesium in the case of dolomite) and 3) volcanic rocks they are made up of poorly soluble silicate minerals which enter solution very slowly, even in the case of high CO2 contents. With the destruction of the crystalline structure and the passage of various ions into solution (mainly Na+, K+, Mg+2, Ca+2), silica and aluminium are also released.
-
The reaction speed with which the different minerals react once in contact with water, which measures the time taken by the chemical elements to enter into solution, depends on the type of mineral and the degree of acidity of the environment. Generally, the reaction rate is favoured by an acidic (aggressive) environment and decreases from evaporites (chlorides and sulphates) to silicates, with carbonates as intermediate terms. This factor, together with solubility, explains the different salt content of the waters that interact with the lithologies reported above.
-
Temperature has a notable influence on both the solubility of minerals and the reaction rate. Generally (but there are some exceptions), the increase in temperature favours the dissolution (disaggregation of the particles) of the minerals; the ions that formed the ordered lattice are dispersed in the water. We thus move from order (the salt lattice) to disorder (the ions scattered in the solution). Furthermore, as the temperature increases the molecules agitate more, making collisions more frequent and therefore increasing the speed of the reactions. For example, thermal waters, due to their temperature and often the presence of carbon dioxide, sometimes in significant concentrations, have a greater aggressive capacity on the rocks with which they come into contact.
-
The residence time in the aquifer favours the interaction between the circulating water and the rocks and the establishment of the processes described above.
ENG (Short Version):
The processes of rock alteration by surface and groundwater release compounds and elements, mostly in the form of ions (positively charged, called cations, and negatively charged, called anions), but also in molecular form. They constitute the salt load of natural water and, based on type and abundance of the different ions, will define both chemical composition and hydrochemical facies to which it belongs. Natural water, therefore, will reflect the chemical composition of the rocks with which it interacted.